Toxicité des néonicotinoïdes : retour sur une épopée scientifique
Publié le 16/10/2025
Stress chimiques
En France, depuis 2018, l’utilisation des pesticides à base de néonicotinoïdes est interdite en agriculture. Cette interdiction provient de plus de vingt ans de travaux scientifiques motivés par les alertes de la filière apicole et sujets à de nombreuses controverses. Si nous pensions que la dangerosité des néonicotinoïdes avait été suffisamment documentée, force est de constater que la proposition de Loi Duplomb a relancé le débat.
Il serait ambitieux et illusoire de vouloir synthétiser l’ensemble des travaux portant sur l’analyse de la toxicité des néonicotinoïdes sur les abeilles, à savoir près de 17 000 publications en 25 ans !
Il serait ambitieux et illusoire de vouloir synthétiser l’ensemble des travaux portant sur l’analyse de la toxicité des néonicotinoïdes sur les abeilles, à savoir près de 17 000 publications en 25 ans ! Ici, il est plutôt retracé une chronologie de travaux scientifiques des partenaires de l’UMT PrADE s’étalant sur plus de 20 ans. Cet article rapporte plusieurs étapes successives formant une progression dans les méthodes de recherche visant à mieux répondre aux attentes de la profession (Figure 1).
Ici, il est plutôt retracé une chronologie de travaux scientifiques des partenaires de l’UMT PrADE s’étalant sur plus de 20 ans. Cet article rapporte plusieurs étapes successives formant une progression dans les méthodes de recherche visant à mieux répondre aux attentes de la profession (Figure 1).
Si ce récit ose un angle personnel, rapportant les résultats de 6 projets de recherche coordonnés par l’auteur, ce n’est pas une épopée individuelle. Au contraire, les aboutissements décrits ici ne sont que le fruit de rencontres et de collaborations. D’abord avec Minh-Hà Pham-Delègue qui a proposé d’appliquer des méthodes de laboratoire jusqu’ici utilisées en écologie chimique et en neurosciences à la question des effets comportementaux des néonicotinoïdes. Puis, les compétences en conception de nouvelles méthodes de l’équipe INRAe du Magneraud dirigée Pierrick Aupinel a contribué au développement de la technique RFID chez l’abeille.
Si ce récit ose un angle personnel, rapportant les résultats de 6 projets de recherche coordonnés par l’auteur, ce n’est pas une épopée individuelle. Au contraire, les aboutissements décrits ici ne sont que le fruit de rencontres et de collaborations. D’abord avec Minh-Hà Pham-Delègue qui a proposé d’appliquer des méthodes de laboratoire jusqu’ici utilisées en écologie chimique et en neurosciences à la question des effets comportementaux des néonicotinoïdes. Puis, les compétences en conception de nouvelles méthodes de l’équipe INRAe du Magneraud dirigée Pierrick Aupinel a contribué au développement de la technique RFID chez l’abeille.
Finalement, la collaboration qui a permis des avancées significatives est celle avec Mickaël Henry de l’INRAe d’Avignon. Grâce à ses approches d’écologie comportementale et du paysage, Mickaël Henry a coordonné des publications avec un impact exceptionnel dans la communauté scientifique et dans les politiques publiques. Finalement, la reconnaissance officielle de la méthode « vol de retour à la ruche » a reposé sur le travail et la ténacité de Julie Fourrier (ITSAP). Ces collaborations se sont inscrites dans un cadre de partenariat apporté par l’unité de recherche UMT PrADE qui a eu pour but de 2010 à 2024 de mettre en cohérence les attentes de la filière avec les projets de recherche.
Finalement, la collaboration qui a permis des avancées significatives est celle avec Mickaël Henry de l’INRAe d’Avignon. Grâce à ses approches d’écologie comportementale et du paysage, Mickaël Henry a coordonné des publications avec un impact exceptionnel dans la communauté scientifique et dans les politiques publiques. Finalement, la reconnaissance officielle de la méthode « vol de retour à la ruche » a reposé sur le travail et la ténacité de Julie Fourrier (ITSAP). Ces collaborations se sont inscrites dans un cadre de partenariat apporté par l’unité de recherche UMT PrADE qui a eu pour but de 2010 à 2024 de mettre en cohérence les attentes de la filière avec les projets de recherche.
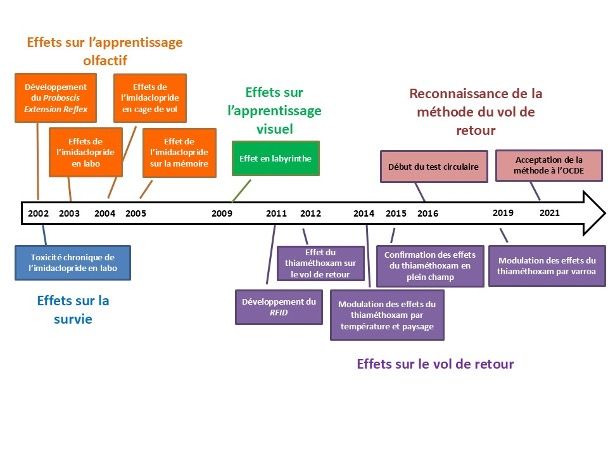
Figure 1 : Chronologie du développement des méthodes et des études mesurant les effets des néonicotinoïdes.
L’alerte des apiculteur.rice.s
Au milieu des années 90, des apiculteurs sonnent l’alerte après leurs observations de ruches dépeuplées et de récoltes de miel diminuées lors de la floraison du tournesol. L’absence d’amas d’abeilles mortes devant ou dans les ruches les amènent à supposer un non-retour à la ruche des butineuses exposées à un insecticide nouvellement utilisé sur le tournesol, Gaucho qui a pour substance active, l’imidacropride. Cet insecticide est le premier représentant de la famille chimique des néonicotinoïdes parce qu’elle agît sur les mêmes cibles du système nerveux que la nicotine.
Au milieu des années 90, des apiculteurs sonnent l’alerte après leurs observations de ruches dépeuplées et de récoltes de miel diminuées lors de la floraison du tournesol. L’absence d’amas d’abeilles mortes devant ou dans les ruches les amènent à supposer un non-retour à la ruche des butineuses exposées à un insecticide nouvellement utilisé sur le tournesol, Gaucho qui a pour substance active, l’imidacropride. Cet insecticide est le premier représentant de la famille chimique des néonicotinoïdes parce qu’elle agît sur les mêmes cibles du système nerveux que la nicotine.
Malgré ce nom barbare, probablement aucune famille de pesticides n’aura été autant connue que les néonicotinoïdes par des personnes extérieures au monde agricole. Cela s’explique par la série sans précédent d’évènements scientifiques, politiques et médiatiques liée aux possibles liens de cause à effet entre l’utilisation de ces insecticides par les agriculteurs et les problèmes rencontrés par les apiculteurs.
Malgré ce nom barbare, probablement aucune famille de pesticides n’aura été autant connue que les néonicotinoïdes par des personnes extérieures au monde agricole. Cela s’explique par la série sans précédent d’évènements scientifiques, politiques et médiatiques liée aux possibles liens de cause à effet entre l’utilisation de ces insecticides par les agriculteurs et les problèmes rencontrés par les apiculteurs.
Les scientifiques se sont emparés de la question des effets supposés de ces insecticides sur l’abeille mellifère. Preuve en est, un tiers des publications scientifiques sur les abeilles et les pesticides portaient sur ces insecticides entre 2013 et 2016. Rapidement les chercheurs ont établi que malgré l’application de l’insecticide sur les graines des plantes – plutôt que par pulvérisation comme classiquement jusqu’ici – des résidus sont détectables par des analyses chimiques performantes dans le nectar ou le pollen récolté par les butineuses.
Les scientifiques se sont emparés de la question des effets supposés de ces insecticides sur l’abeille mellifère. Preuve en est, un tiers des publications scientifiques sur les abeilles et les pesticides portaient sur ces insecticides entre 2013 et 2016. Rapidement les chercheurs ont établi que malgré l’application de l’insecticide sur les graines des plantes – plutôt que par pulvérisation comme classiquement jusqu’ici – des résidus sont détectables par des analyses chimiques performantes dans le nectar ou le pollen récolté par les butineuses.
Cette présence de la molécule insecticide dans les ressources des abeilles des mois après le semis des graines traitées s’explique par sa capacité à se propager dans les tissus de la plante via la sève. Une caractéristique intéressante pour les agriculteurs qui veulent protéger leurs cultures des insectes qui piquent les tissus végétaux pour se nourrir de la sève, comme les pucerons.
Cette présence de la molécule insecticide dans les ressources des abeilles des mois après le semis des graines traitées s’explique par sa capacité à se propager dans les tissus de la plante via la sève. Une caractéristique intéressante pour les agriculteurs qui veulent protéger leurs cultures des insectes qui piquent les tissus végétaux pour se nourrir de la sève, comme les pucerons.
Un récit scientifique plein « de tumultes et de rebondissements » débute alors il y a 20 ans pour comprendre si ces faibles quantités d’insecticides peuvent expliquer les anomalies constatées par les apiculteurs dans leurs colonies.
Le labo, un passage obligé
Une première série d’études est effectuée pour mesurer en laboratoire les capacités d’apprentissage d’abeilles. Pour cela, on les conditionne à tirer la langue (appelé « proboscis ») à une odeur. Dans des conditions normales, une abeille qui a été précédemment nourrie en présence d’une odeur, apprend très rapidement à tirer la langue lorsqu’elle rencontre l’odeur seule. Dans la nature, elle doit en effet apprendre l’odeur des fleurs pour reconnaitre l’espèce végétale qui lui apportera la ressource attendue.
Une première série d’études est effectuée pour mesurer en laboratoire les capacités d’apprentissage d’abeilles. Pour cela, on les conditionne à tirer la langue (appelé « proboscis ») à une odeur. Dans des conditions normales, une abeille qui a été précédemment nourrie en présence d’une odeur, apprend très rapidement à tirer la langue lorsqu’elle rencontre l’odeur seule. Dans la nature, elle doit en effet apprendre l’odeur des fleurs pour reconnaitre l’espèce végétale qui lui apportera la ressource attendue.
Elle associe alors l’odeur à la récompense alimentaire. Mais des abeilles exposées à des doses de néonicotinoïde, suffisamment faibles pour ne pas affecter leur survie (on parle de « doses sublétales »), ont des performances d’apprentissage diminuées. Plus précisément, il a été démontré qu’en agissant sur le cerveau de l’abeille l’insecticide imidaclopride affecte la consolidation de l’information nouvelle apprise, empêchant l’abeille de garder en mémoire l’odeur comme un signal associé à la nourriture. Il était alors supposé que la butineuse exposée serait dans l’incapacité de reconnaitre la fleur à visiter.
Elle associe alors l’odeur à la récompense alimentaire. Mais des abeilles exposées à des doses de néonicotinoïde, suffisamment faibles pour ne pas affecter leur survie (on parle de « doses sublétales »), ont des performances d’apprentissage diminuées. Plus précisément, il a été démontré qu’en agissant sur le cerveau de l’abeille l’insecticide imidaclopride affecte la consolidation de l’information nouvelle apprise, empêchant l’abeille de garder en mémoire l’odeur comme un signal associé à la nourriture. Il était alors supposé que la butineuse exposée serait dans l’incapacité de reconnaitre la fleur à visiter.
Alors que ces résultats ont été reproduits par plusieurs équipes, et que l’effet a été confirmé chez des butineuses volant librement, la méthode a été contestée car trop éloignée des conditions naturelles et de l’hypothèse initiale de désorientation des butineuses (Thompson et al., 2003). Pour tenter de répondre à cette critique, une autre expérimentation a été mise en place, toujours basée sur l’apprentissage, mais cette fois-ci d’un repère visuel et non d’une odeur. Dans un premier temps, des butineuses apprennent à associer le repère, un carré vert, à une récompense sucrée, puis elles doivent se diriger en vol libre dans un labyrinthe en suivant le chemin indiqué par le repère.
Alors que ces résultats ont été reproduits par plusieurs équipes, et que l’effet a été confirmé chez des butineuses volant librement, la méthode a été contestée car trop éloignée des conditions naturelles et de l’hypothèse initiale de désorientation des butineuses (Thompson et al., 2003). Pour tenter de répondre à cette critique, une autre expérimentation a été mise en place, toujours basée sur l’apprentissage, mais cette fois-ci d’un repère visuel et non d’une odeur. Dans un premier temps, des butineuses apprennent à associer le repère, un carré vert, à une récompense sucrée, puis elles doivent se diriger en vol libre dans un labyrinthe en suivant le chemin indiqué par le repère.
Dans « la vraie vie », les butineuses doivent faire de même en apprenant des repères (haies, lisières, route…) pour naviguer entre leur ruche et les fleurs (ou l’eau, le miellat, la propolis). La tâche de suivre le bon chemin dans le labyrinthe en se repérant avec la tâche verte, jusqu’au but qui est le sirop, ne pose aucun problème aux butineuses non exposées. En revanche l’exposition à une faible dose d’insecticide augmente, jusqu’à un facteur 7, le nombre d’individus n’atteignant pas le but. Mais là encore les conditions expérimentales sont loin de la situation réelle où les butineuses doivent parcourir parfois plusieurs kilomètres, en exécutant plusieurs tâches cognitives en même temps : reconnaitre les lieux et les fleurs, s’orienter d’après le soleil…
Dans « la vraie vie », les butineuses doivent faire de même en apprenant des repères (haies, lisières, route…) pour naviguer entre leur ruche et les fleurs (ou l’eau, le miellat, la propolis). La tâche de suivre le bon chemin dans le labyrinthe en se repérant avec la tâche verte, jusqu’au but qui est le sirop, ne pose aucun problème aux butineuses non exposées. En revanche l’exposition à une faible dose d’insecticide augmente, jusqu’à un facteur 7, le nombre d’individus n’atteignant pas le but. Mais là encore les conditions expérimentales sont loin de la situation réelle où les butineuses doivent parcourir parfois plusieurs kilomètres, en exécutant plusieurs tâches cognitives en même temps : reconnaitre les lieux et les fleurs, s’orienter d’après le soleil…
Les RFID révolutionnent les expérimentations
Après ces années d’investigation en laboratoire, il nous fallait trouver le moyen d’étudier le phénomène chez des butineuses volant librement en conditions réelles. Nous butions alors sur un problème non trivial : comment savoir de façon fiable qu’une butineuse revient à la ruche ou pas ? Après 4 ans, la technologie qui résoudra le problème est développée et dès lors des avancées majeures dans l’étude des abeilles en plein champ seront faites.
Après ces années d’investigation en laboratoire, il nous fallait trouver le moyen d’étudier le phénomène chez des butineuses volant librement en conditions réelles. Nous butions alors sur un problème non trivial : comment savoir de façon fiable qu’une butineuse revient à la ruche ou pas ? Après 4 ans, la technologie qui résoudra le problème est développée et dès lors des avancées majeures dans l’étude des abeilles en plein champ seront faites.
Nous avons choisi d’investir dans le développement l’application de l’outil RFID (RadioFrequency Identification Device), en vérifiant son innocuité, en miniaturisant les puces électroniques collées sur les abeilles, en trouvant la bonne méthode de collage des puces, puis en organisant la collecte et l’analyse des données (Decourtye et al., 2011). Les puces RFID, contiennent un identifiant alphanumérique unique, répercuté passivement – sans source d’énergie embarquée – par signal radio, vers des lecteurs électroniques.
Nous avons choisi d’investir dans le développement l’application de l’outil RFID (RadioFrequency Identification Device), en vérifiant son innocuité, en miniaturisant les puces électroniques collées sur les abeilles, en trouvant la bonne méthode de collage des puces, puis en organisant la collecte et l’analyse des données (Decourtye et al., 2011). Les puces RFID, contiennent un identifiant alphanumérique unique, répercuté passivement – sans source d’énergie embarquée – par signal radio, vers des lecteurs électroniques.
L’application de ces puces couvre un champ d’activités extrêmement large, de la traçabilité de marchandises aux systèmes antivol, en passant par l’identification d’animaux d’élevage. La puce utilisée sur l’abeille pèse de 3 à 4 milligrammes, soit 3 à 4 % du poids d’une abeille et reste bien inférieur aux 70 milligrammes de nectar que peut transporter le jabot des butineuses. Cette puce est collée sur le thorax de l’abeille à l’aide d’une colle inoffensive utilisée en dentisterie humaine.
L’application de ces puces couvre un champ d’activités extrêmement large, de la traçabilité de marchandises aux systèmes antivol, en passant par l’identification d’animaux d’élevage. La puce utilisée sur l’abeille pèse de 3 à 4 milligrammes, soit 3 à 4 % du poids d’une abeille et reste bien inférieur aux 70 milligrammes de nectar que peut transporter le jabot des butineuses. Cette puce est collée sur le thorax de l’abeille à l’aide d’une colle inoffensive utilisée en dentisterie humaine.
La distance de lecture entre la puce et le lecteur n’est que de quelques millimètres seulement, ne permettant donc pas de localiser les abeilles lors de leur vol. En revanche, ce dispositif permet d’enregistrer, à la seconde près, l’heure de passage d’une abeille sous des lecteurs positionnés à l’entrée de la ruche
La distance de lecture entre la puce et le lecteur n’est que de quelques millimètres seulement, ne permettant donc pas de localiser les abeilles lors de leur vol. En revanche, ce dispositif permet d’enregistrer, à la seconde près, l’heure de passage d’une abeille sous des lecteurs positionnés à l’entrée de la ruche
L’hypothèse posée par les apiculteur.rice.s est confirmée
Notre technique a consisté à équiper l’entrée de la ruche de lecteurs RFID et de relâcher les butineuses en des points stratégiques afin de mesurer leur capacité à retourner à la ruche après une exposition à l’insecticide. L’attention a été portée sur le thiaméthoxam, substance active des spécialités commerciales Cruiser® et Cruiser OSR®, utilisée dans de nombreux pays en traitement de semences de cultures butinées par les abeilles (notamment le colza pour le nectar et le pollen). Plus de 650 abeilles ont été identifiées avec les puces RFID, dont la moitié des individus ont été nourris avec une solution sucrée contenant une dose non létale de 1,34 ng de thiaméthoxam (quantifiée par analyses chimiques) pour simuler une exposition par du nectar contaminé.
Notre technique a consisté à équiper l’entrée de la ruche de lecteurs RFID et de relâcher les butineuses en des points stratégiques afin de mesurer leur capacité à retourner à la ruche après une exposition à l’insecticide. L’attention a été portée sur le thiaméthoxam, substance active des spécialités commerciales Cruiser® et Cruiser OSR®, utilisée dans de nombreux pays en traitement de semences de cultures butinées par les abeilles (notamment le colza pour le nectar et le pollen). Plus de 650 abeilles ont été identifiées avec les puces RFID, dont la moitié des individus ont été nourris avec une solution sucrée contenant une dose non létale de 1,34 ng de thiaméthoxam (quantifiée par analyses chimiques) pour simuler une exposition par du nectar contaminé.
Ces butineuses ont ensuite été relâchées à 1 km de leur ruche, considérée comme une distance moyenne de butinage chez les abeilles mellifères. Parallèlement, les autres individus ont été nourris avec une solution non contaminée, puis relâchés en même temps que les individus contaminés, afin de faire office de groupe témoin. Ainsi, en comparant entre les deux groupes d'abeilles les proportions de retours à la ruche, on a pu évaluer le taux de disparition imputable à l'exposition au produit testé. Cette étude testait l’hypothèse qu'une faible dose de thiaméthoxam, même si elle n’induit pas une mortalité directe, pourrait induire la disparition des abeilles par un phénomène de désorientation.
Ces butineuses ont ensuite été relâchées à 1 km de leur ruche, considérée comme une distance moyenne de butinage chez les abeilles mellifères. Parallèlement, les autres individus ont été nourris avec une solution non contaminée, puis relâchés en même temps que les individus contaminés, afin de faire office de groupe témoin. Ainsi, en comparant entre les deux groupes d'abeilles les proportions de retours à la ruche, on a pu évaluer le taux de disparition imputable à l'exposition au produit testé. Cette étude testait l’hypothèse qu'une faible dose de thiaméthoxam, même si elle n’induit pas une mortalité directe, pourrait induire la disparition des abeilles par un phénomène de désorientation.
Dans le premier dispositif expérimental utilisé, nous nous assurions que les butineuses devaient avoir déjà parcouru le trajet entre le point de relâcher et leur ruche. Pour ce faire, la ruche a été positionnée à proximité (70 m) ou à 1 km d'une parcelle expérimentale de phacélie – une plante fleurie très attractive pour les abeilles, non présente aux alentours de la ruche en dehors de cette parcelle et produisant un pollen bleu qui est distinguable des autres sources de pollens.
Dans le premier dispositif expérimental utilisé, nous nous assurions que les butineuses devaient avoir déjà parcouru le trajet entre le point de relâcher et leur ruche. Pour ce faire, la ruche a été positionnée à proximité (70 m) ou à 1 km d'une parcelle expérimentale de phacélie – une plante fleurie très attractive pour les abeilles, non présente aux alentours de la ruche en dehors de cette parcelle et produisant un pollen bleu qui est distinguable des autres sources de pollens.
Les butineuses revenant à la ruche avec du pollen de phacélie ont été capturées devant la ruche. Elles avaient donc parcouru au moins une fois le trajet entre la parcelle et leur ruche. Ces individus ont ensuite été équipés d'une puce RFID, contaminés expérimentalement en laboratoire – ou non pour les individus témoins – et relâchés depuis la parcelle de phacélie précédemment butinée.
Les butineuses revenant à la ruche avec du pollen de phacélie ont été capturées devant la ruche. Elles avaient donc parcouru au moins une fois le trajet entre la parcelle et leur ruche. Ces individus ont ensuite été équipés d'une puce RFID, contaminés expérimentalement en laboratoire – ou non pour les individus témoins – et relâchés depuis la parcelle de phacélie précédemment butinée.
Outre celles des butineuses connaissant le trajet du retour, nous avons étudié les performances de retour de butineuses plus naïves par rapport au trajet du retour. Il est en effet important de noter qu'en conditions naturelles, les abeilles ne sont pas toutes familiarisées avec le chemin devant les mener à leur ruche. C'est le cas des jeunes butineuses, des « éclaireuses » dont le rôle est de trouver de nouvelles ressources florales, mais aussi des butineuses qui se rendent pour la première fois sur une ressource florale sur la simple base des informations qui leur ont été transmises par les éclaireuses.
Outre celles des butineuses connaissant le trajet du retour, nous avons étudié les performances de retour de butineuses plus naïves par rapport au trajet du retour. Il est en effet important de noter qu'en conditions naturelles, les abeilles ne sont pas toutes familiarisées avec le chemin devant les mener à leur ruche. C'est le cas des jeunes butineuses, des « éclaireuses » dont le rôle est de trouver de nouvelles ressources florales, mais aussi des butineuses qui se rendent pour la première fois sur une ressource florale sur la simple base des informations qui leur ont été transmises par les éclaireuses.
La tâche pour ces abeilles est ainsi plus ardue car elles doivent retrouver la maison en ayant jamais parcouru le trajet. On peut facilement imaginer que les risques d’erreur de navigation sont plus élevés par rapport aux trajets qu’elles parcourront après plusieurs expériences. Notre démarche a donc été répétée avec des individus relâchés, toujours à 1 km de leur ruche, mais à un point aléatoire par rapport à leurs précédentes expériences de butinage.
La tâche pour ces abeilles est ainsi plus ardue car elles doivent retrouver la maison en ayant jamais parcouru le trajet. On peut facilement imaginer que les risques d’erreur de navigation sont plus élevés par rapport aux trajets qu’elles parcourront après plusieurs expériences. Notre démarche a donc été répétée avec des individus relâchés, toujours à 1 km de leur ruche, mais à un point aléatoire par rapport à leurs précédentes expériences de butinage.
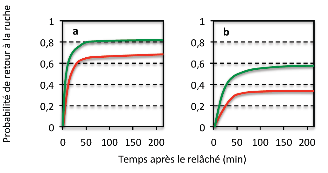
Figure 2 : Effet de l’exposition orale des abeilles butineuses à la dose de 1,3 ng/abeille de thiaméthoxam sur le vol de retour à la ruche. En rouge, le lot d’abeilles exposées, en vert le lot d’abeilles non exposées. (a) relâché à un point connu par les butineuses, (b) relâché à un point aléatoire (Requier et al., 2014).
Les deux situations, avec butineuses familiarisées ou non, ont mis en évidence une mortalité significative des abeilles par un phénomène de désorientation dû à l'intoxication (Figure 2). Lorsqu'elle est combinée à la mortalité naturelle (15 % des butineuses par jour), cette disparition liée à l'insecticide aboutit à une mortalité totale journalière de 25 % à 47 % chez les butineuses intoxiquées, soit jusqu'à trois fois le taux mesuré chez les témoins. L’effet sur les pertes des butineuses a également été confirmé chez les butineuses relâchées sur un site familier et très près de la ruche (70 m ; résultats non montrés).
Une désorientation décortiquée
Pour comprendre les mécanismes cognitifs et neurologiques qui sous-tendent nos résultats, il faut s’intéresser aux travaux de collègues. En raison de leur puissante action neurotoxique, les néonicotinoïdes peuvent altérer le fonctionnement du système nerveux central des insectes et altérer leur capacités cognitives (Palmer et al., 2013). Ces insecticides agissent au niveau de centres supérieurs du cerveau de l’abeille, qui intègrent des informations visuelles ainsi qu’une grande part de l’information olfactive et gustative, pour être le siège de la mémorisation à long terme.
Pour comprendre les mécanismes cognitifs et neurologiques qui sous-tendent nos résultats, il faut s’intéresser aux travaux de collègues. En raison de leur puissante action neurotoxique, les néonicotinoïdes peuvent altérer le fonctionnement du système nerveux central des insectes et altérer leur capacités cognitives (Palmer et al., 2013). Ces insecticides agissent au niveau de centres supérieurs du cerveau de l’abeille, qui intègrent des informations visuelles ainsi qu’une grande part de l’information olfactive et gustative, pour être le siège de la mémorisation à long terme.
Après son exposition à l’insecticide, même à de faibles doses, la butineuse se trouve être dans l’incapacité de mobiliser les informations qu’elle a précédemment apprises et qui lui permettent de retrouver le chemin du retour. Plus précisément, sa capacité à s’orienter grâce à la lecture des repères visuels que constituent les éléments du paysage (haies, chemins, routes…) est altérée. La navigation de la butineuse en vol dépend, dans un premier temps, de sa capacité à apprendre la position de la ruche par rapport à la course du soleil dans le ciel et à des repères fixes du paysage lors des vols d’orientation.
Après son exposition à l’insecticide, même à de faibles doses, la butineuse se trouve être dans l’incapacité de mobiliser les informations qu’elle a précédemment apprises et qui lui permettent de retrouver le chemin du retour. Plus précisément, sa capacité à s’orienter grâce à la lecture des repères visuels que constituent les éléments du paysage (haies, chemins, routes…) est altérée. La navigation de la butineuse en vol dépend, dans un premier temps, de sa capacité à apprendre la position de la ruche par rapport à la course du soleil dans le ciel et à des repères fixes du paysage lors des vols d’orientation.
Lors de ses premières sorties de la ruche, la prospection des environs de la ruche va permettre à l’ouvrière de localiser sa ruche dans l’environnement. Puis dans un second temps, lorsque qu’elle deviendra butineuse, elle devra remobiliser les informations mémorisées dans son système nerveux central pour « lire » le paysage comme une carte la menant à sa ruche.
Lors de ses premières sorties de la ruche, la prospection des environs de la ruche va permettre à l’ouvrière de localiser sa ruche dans l’environnement. Puis dans un second temps, lorsque qu’elle deviendra butineuse, elle devra remobiliser les informations mémorisées dans son système nerveux central pour « lire » le paysage comme une carte la menant à sa ruche.
Des études (Fischer et al., 2014 ; Tison et al., 2016) ont montré que par son action neuronale au niveau d’une partie du cerveau de l’abeille - les corps pédonculés, qui sont le siège de la mémorisation à long terme, l’équivalent de l’hippocampe chez les mammifères - l’insecticide affecterait le processus cognitif de rappel de l’information précédemment apprise.
Des études (Fischer et al., 2014 ; Tison et al., 2016) ont montré que par son action neuronale au niveau d’une partie du cerveau de l’abeille - les corps pédonculés, qui sont le siège de la mémorisation à long terme, l’équivalent de l’hippocampe chez les mammifères - l’insecticide affecterait le processus cognitif de rappel de l’information précédemment apprise.
Des effets variables selon le paysage et Varroa
Nous avons montré que, selon le contexte paysager ou météorologique, l’effet du pesticide peut être sous-estimé ou surestimé d’un facteur six. L’effet est d’autant plus marqué que la température ambiante est basse. Et plus le paysage est complexe, en présentant des haies et des lisières qui créent des obstacles pour la navigation, plus l’effet du néonicotinoïde sur le vol de retour des butineuses est élevé (Henry et al., 2014). Le taux de disparition lié à l'insecticide est ainsi modulé par l’environnement paysager, atteignant 35 % dans les paysages bocagers contre 18 % dans les paysages ouverts, caractéristiques des plaines céréalières.
Nous avons montré que, selon le contexte paysager ou météorologique, l’effet du pesticide peut être sous-estimé ou surestimé d’un facteur six. L’effet est d’autant plus marqué que la température ambiante est basse. Et plus le paysage est complexe, en présentant des haies et des lisières qui créent des obstacles pour la navigation, plus l’effet du néonicotinoïde sur le vol de retour des butineuses est élevé (Henry et al., 2014). Le taux de disparition lié à l'insecticide est ainsi modulé par l’environnement paysager, atteignant 35 % dans les paysages bocagers contre 18 % dans les paysages ouverts, caractéristiques des plaines céréalières.
Les travaux cités dans le chapitre précédent qui ont démontré l’inhibition par les néonicotinoïdes de la capacité à remobiliser la mémoire spatiale donnent une explication à nos résultats : sous l’effet neurotoxique de l’insecticide, les butineuses se retrouveraient dans l’incapacité de déchiffrer la carte complexe du paysage qui les mène à leur ruche. Un réseau bocager dense deviendrait alors un véritable labyrinthe pour ces abeilles, devenues moins aptes à reconnaître leurs repères visuels.
Les travaux cités dans le chapitre précédent qui ont démontré l’inhibition par les néonicotinoïdes de la capacité à remobiliser la mémoire spatiale donnent une explication à nos résultats : sous l’effet neurotoxique de l’insecticide, les butineuses se retrouveraient dans l’incapacité de déchiffrer la carte complexe du paysage qui les mène à leur ruche. Un réseau bocager dense deviendrait alors un véritable labyrinthe pour ces abeilles, devenues moins aptes à reconnaître leurs repères visuels.
Puis nous avons étudié la modulation des effets du thiaméthoxam sur le retour à la ruche des butineuses en fonction de l’état sanitaire de la colonie, et en particulier en fonction de la pression liée à Varroa et aux virus associés à ce parasite (Monchanin et al., 2019). Pour cela, nous avons mesuré les effets de l’insecticide à 3 doses sublétales (0,11, 0,33 et 1 ng/abeille) chez des butineuses provenant de colonies présentant un gradient d’infestation en Varroa.
Puis nous avons étudié la modulation des effets du thiaméthoxam sur le retour à la ruche des butineuses en fonction de l’état sanitaire de la colonie, et en particulier en fonction de la pression liée à Varroa et aux virus associés à ce parasite (Monchanin et al., 2019). Pour cela, nous avons mesuré les effets de l’insecticide à 3 doses sublétales (0,11, 0,33 et 1 ng/abeille) chez des butineuses provenant de colonies présentant un gradient d’infestation en Varroa.
L’effet délétère sur le succès de retour à la ruche du thiaméthoxam appliqué à la plus forte dose a été d’autant plus marqué que la colonie fût infestée avec varroa. Nous montrons par exemple que l’effet du produit peut être multiplié par un facteur 3 lorsqu’une colonie atteint un taux d’infestation de 5 varroas pour 100 abeilles.
L’effet délétère sur le succès de retour à la ruche du thiaméthoxam appliqué à la plus forte dose a été d’autant plus marqué que la colonie fût infestée avec varroa. Nous montrons par exemple que l’effet du produit peut être multiplié par un facteur 3 lorsqu’une colonie atteint un taux d’infestation de 5 varroas pour 100 abeilles.
Les effets confirmés sur le terrain
Après 2012, le deuxième fait majeur de cette épopée scientifique peut être situé en 2015, lorsque nous confirmerons pour la première fois l’impact d’un insecticide néonicotinoïde sur la survie des ouvrières en conditions réelles d’exposition au champ.
Après 2012, le deuxième fait majeur de cette épopée scientifique peut être situé en 2015, lorsque nous confirmerons pour la première fois l’impact d’un insecticide néonicotinoïde sur la survie des ouvrières en conditions réelles d’exposition au champ.
Pour cela, un essai sur le terrain a été mené afin d'évaluer les effets du thiaméthoxam en exposant des abeilles à du colza traité avec le produit commercial Cruiser OSR®, c'est-à-dire conformément aux pratiques agricoles habituelles (Henry et al., 2015). Dans ces conditions d'exposition réalistes, un effet négatif des néonicotinoïdes sur la survie des abeilles a été confirmé.
Pour cela, un essai sur le terrain a été mené afin d'évaluer les effets du thiaméthoxam en exposant des abeilles à du colza traité avec le produit commercial Cruiser OSR®, c'est-à-dire conformément aux pratiques agricoles habituelles (Henry et al., 2015). Dans ces conditions d'exposition réalistes, un effet négatif des néonicotinoïdes sur la survie des abeilles a été confirmé.
L’impact sur les politiques publiques
Le délai entre les premiers travaux scientifiques sur l’effet de faibles doses des néonicotinoïdes sur l’orientation des butineuses et leur impact final sur la politique publique a été de 14 ans. La question a été posée par des apiculteurs à la fin des années 90. La mise au point de la technologie RFID sur l’abeille mellifère a débuté en 2006 et notre publication prouvant l’effet est parue fin mars 2012. Fin juillet 2012, le ministre chargé de l’agriculture signait l’arrêté relatif à l'interdiction d'utilisation et de mise sur le marché du pesticide Cruiser OSR®. L’analyse des impacts de la recherche publique agronomique a établi un délai moyen entre les premiers travaux scientifiques sur un sujet et son impact chez les acteurs socio-économiques de 19,4 ans (Colinet et al., 2014).
Le délai entre les premiers travaux scientifiques sur l’effet de faibles doses des néonicotinoïdes sur l’orientation des butineuses et leur impact final sur la politique publique a été de 14 ans. La question a été posée par des apiculteurs à la fin des années 90. La mise au point de la technologie RFID sur l’abeille mellifère a débuté en 2006 et notre publication prouvant l’effet est parue fin mars 2012. Fin juillet 2012, le ministre chargé de l’agriculture signait l’arrêté relatif à l'interdiction d'utilisation et de mise sur le marché du pesticide Cruiser OSR®. L’analyse des impacts de la recherche publique agronomique a établi un délai moyen entre les premiers travaux scientifiques sur un sujet et son impact chez les acteurs socio-économiques de 19,4 ans (Colinet et al., 2014).
Cette analyse, s’appuyant sur 30 cas de recherche, souligne le délai exceptionnellement court (4 mois) entre la production du produit final de la recherche, ici la démonstration par notre publication de Henry et al. (2012), et la génération d’un impact politique. Outre la décision du ministre, l’étude a eu un autre impact sur la politique réglementaire au niveau européen puisqu’elle a largement participé à la remise en question des procédures d’évaluation des pesticides avant leur mise sur le marché (Decourtye et al., 2013 ; EFSA, 2015 ; https://itsap.asso.fr/articles/vers-une-meilleure-protection-des-abeilles-revision-des-procedures-d-evaluation-des-risques-des-pesticides). La méthode de vol de retour a été validée par l’OCDE comme une ligne directrice à utiliser avant la mise sur le marché des pesticides (https://itsap.asso.fr/articles/effet-d-un-insecticide-sur-le-vol-de-retour#up).
Cette analyse, s’appuyant sur 30 cas de recherche, souligne le délai exceptionnellement court (4 mois) entre la production du produit final de la recherche, ici la démonstration par notre publication de Henry et al. (2012), et la génération d’un impact politique. Outre la décision du ministre, l’étude a eu un autre impact sur la politique réglementaire au niveau européen puisqu’elle a largement participé à la remise en question des procédures d’évaluation des pesticides avant leur mise sur le marché (Decourtye et al., 2013 ; EFSA, 2015 ; https://itsap.asso.fr/articles/vers-une-meilleure-protection-des-abeilles-revision-des-procedures-d-evaluation-des-risques-des-pesticides). La méthode de vol de retour a été validée par l’OCDE comme une ligne directrice à utiliser avant la mise sur le marché des pesticides (https://itsap.asso.fr/articles/effet-d-un-insecticide-sur-le-vol-de-retour#up).
Auteur :
Axel Decourtye
Références bibliographiques
•Decourtye A., Devillers J., Aupinel P., Brun F., Bagnis C., Fourrier J., Gauthier M., 2011. Honeybee tracking with microchips: a new methodology to measure the effects of pesticides. Ecotoxicology 20, 429-437.
•Decourtye A., Henry A., Desneux N., 2013. Overhaul pesticide testing on bees. Nature 497, 188.
•EFSA, 2015. Conclusion on the peer review of the pesticide risk assessment for bees for the active substance imidacloprid considering all uses other than seed treatments and granules. EFSA Journal 13(8), 4211.
•Fischer J., Müller T., Spatz A.-K., Greggers .U, Grünewald B., Menzel R., 2014. Neonicotinoids Interfere with Specific Components of Navigation in Honeybees. PLoS ONE 9(3), e91364.
•Henry M., Beguin M., Requier F., Rollin O., Odoux J.-F., Aupinel P., Aptel J., Tchamitchian S., Decourtye A., 2012. A Common Pesticide Decreases Foraging Success and Survival in Honey Bees. Science 336, 348-350.
•Henry M., Bertrand B., Le Féon V., Requier F., Odoux J.-F., Aupinel P., Bretagnolle V., Decourtye A., 2014. Pesticide risk assessment in free-ranging bees is weather and landscape dependent. Nature Communications. 5, 4359.
•Henry M., Cerrutti N., Aupinel P., Decourtye A., Gayrard M., Odoux J.-F., Pissard A., Rüger C., Bretagnolle V., 2015. Reconciling laboratory and field assessments of neonicotinoid toxicity to honeybees. Proceedings of the Royal Society B. 282, 20152110.
•Decourtye A., Devillers J., Aupinel P., Brun F., Bagnis C., Fourrier J., Gauthier M., 2011. Honeybee tracking with microchips: a new methodology to measure the effects of pesticides. Ecotoxicology 20, 429-437.
•Decourtye A., Henry A., Desneux N., 2013. Overhaul pesticide testing on bees. Nature 497, 188.
•EFSA, 2015. Conclusion on the peer review of the pesticide risk assessment for bees for the active substance imidacloprid considering all uses other than seed treatments and granules. EFSA Journal 13(8), 4211.
•Fischer J., Müller T., Spatz A.-K., Greggers .U, Grünewald B., Menzel R., 2014. Neonicotinoids Interfere with Specific Components of Navigation in Honeybees. PLoS ONE 9(3), e91364.
•Henry M., Beguin M., Requier F., Rollin O., Odoux J.-F., Aupinel P., Aptel J., Tchamitchian S., Decourtye A., 2012. A Common Pesticide Decreases Foraging Success and Survival in Honey Bees. Science 336, 348-350.
•Henry M., Bertrand B., Le Féon V., Requier F., Odoux J.-F., Aupinel P., Bretagnolle V., Decourtye A., 2014. Pesticide risk assessment in free-ranging bees is weather and landscape dependent. Nature Communications. 5, 4359.
•Henry M., Cerrutti N., Aupinel P., Decourtye A., Gayrard M., Odoux J.-F., Pissard A., Rüger C., Bretagnolle V., 2015. Reconciling laboratory and field assessments of neonicotinoid toxicity to honeybees. Proceedings of the Royal Society B. 282, 20152110.
•Monchanin, C., Henry, M., Decourtye, A., Dalmon, A., Fortini, D., Boeuf, E., ... & Fourrier, J. (2019). Hazard of a neonicotinoid insecticide on the homing flight of the honeybee depends on climatic conditions and Varroa infestation. Chemosphere, 224, 360-368
•Palmer M.J., Moffat C., Saranzewa N., Harvey J., Wright G.A, Connolly C.N., 2013. Cholinergic pesticides cause mushroom body neuronal inactivation in honeybees. Nature Communications 4, 1634.
•Requier F., Henry M., Decourtye A., 2014. Les puces RFID volent au secours des abeilles. Biofutur 357, 46-51.
•Tison L., Hahn M., Holtz S., Greggers U., Bischoff G., Menzel R., 2016. Honey bees’ behavior is impaired by chronic exposure to the neonicotinoid thiacloprid in the field. Environmental Science and Technology 50(13), 7218-7227.
•Thompson H.M., 2003. Behavioural effects of pesticides in bees - Their potential for use in risk assessment. Ecotoxicology, 12, 317–330. http://doi.org/10.1023/a:1022575315413
•Monchanin, C., Henry, M., Decourtye, A., Dalmon, A., Fortini, D., Boeuf, E., ... & Fourrier, J. (2019). Hazard of a neonicotinoid insecticide on the homing flight of the honeybee depends on climatic conditions and Varroa infestation. Chemosphere, 224, 360-368
•Palmer M.J., Moffat C., Saranzewa N., Harvey J., Wright G.A, Connolly C.N., 2013. Cholinergic pesticides cause mushroom body neuronal inactivation in honeybees. Nature Communications 4, 1634.
•Requier F., Henry M., Decourtye A., 2014. Les puces RFID volent au secours des abeilles. Biofutur 357, 46-51.
•Tison L., Hahn M., Holtz S., Greggers U., Bischoff G., Menzel R., 2016. Honey bees’ behavior is impaired by chronic exposure to the neonicotinoid thiacloprid in the field. Environmental Science and Technology 50(13), 7218-7227.
•Thompson H.M., 2003. Behavioural effects of pesticides in bees - Their potential for use in risk assessment. Ecotoxicology, 12, 317–330. http://doi.org/10.1023/a:1022575315413
s'inscrire à la newsletter
Vous y retrouverez les actualités de nos dernières recherches, événements, publications, infos clés à savoir en tant qu'apiculteur.